恶性脑胶质瘤患者的生存率极低,外科手术联合化疗、放疗的治疗效果不佳。利用传统纳米载体递送药物在一定程度上可以改善化疗药物在肿瘤部位的蓄积,但其安全性和靶向性等仍然是巨大的挑战。研究发现,以细胞或细胞膜作为仿生运输载体的递送系统具有良好的生物相容性、安全性、稳定性和高效靶向性等特点,可以增强治疗药物在肿瘤部位的蓄积,显著提高药效。
小胶质细胞是中枢神经系统特有的巨噬细胞,被激活后可上调其细胞膜表面特异性受体的表达,通过与脑胶质瘤微环境中产生的趋化因子相互作用,可以被募集至脑胶质瘤部位,并利用其自主跨越血脑屏障的能力高效靶向脑胶质瘤。
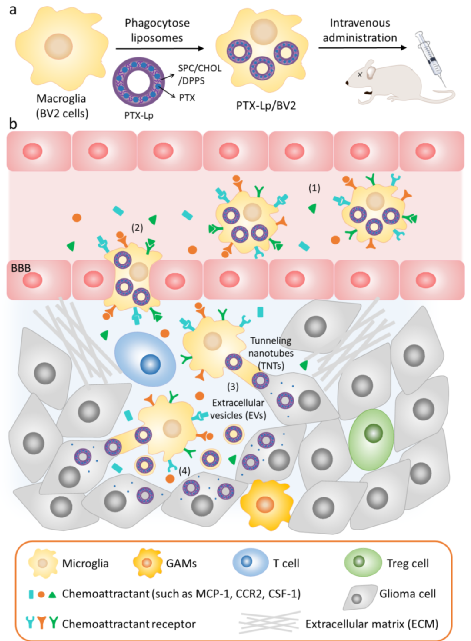
2021年2月28日,杜祎甜在Adv Healthc Mater杂志上发表了一篇题为Engineered Microglia Potentiate the Action of Drugs against Glioma Through Extracellular Vesicles and Tunneling Nanotubes的论文,该研究指出携带紫杉醇脂质体的工程化小胶质细胞具有很强的靶向大脑、跨越血脑屏障、穿透胶质瘤和抑制肿瘤生长的能力,更重要的是工程化的小胶质细胞通过细胞外囊泡和隧道纳米管的细胞间信息交流方式向肿瘤细胞主动递送药物,为活细胞仿生载体和利用隧道纳米管进行仿生递送系统的设计提供了新的思路。

作者将紫杉醇(PTX)包载在脂质体中,以隔绝药物和细胞,防止药物被降解同时避免小胶质细胞受到PTX毒性的影响。利用磷脂酰丝氨酸(PS)的“吃我”信号,将二棕榈酰磷脂酰丝氨酸(DPPS)掺杂到脂质体中,以激活和增强小胶质细胞对脂质体的吞噬。从而使小胶质细胞(BV2)吞噬载药的脂质体(PTX-Lp),得到工程化小胶质细胞(PTX-Lp/BV2)。
研究表明,PTX-Lp/BV2可以有效载药并能够维持原本的细胞活性与生理状态,对体外肿瘤球具有良好的穿透能力和抑制其生长的能力,在胶质瘤细胞的诱导下可以自主跨越血脑屏障,在体内试验中体现出很强的靶向大脑、穿透胶质瘤和抑制肿瘤生长的能力,为活细胞作为递送载体的脑胶质瘤治疗提供了有效参考。
更重要的是,本研究揭示了细胞外囊泡和隧道纳米管作为工程化小胶质细胞向胶质瘤细胞主动递送药物的关键途径,使得活细胞载体具有比传统脂质体更好的药物递送效率和抗肿瘤效果。一方面为活细胞仿生载体高效递送药物的机制提供了理论依据,另一方面为隧道纳米管作为新一代仿生递送体系的研究提供了实验基础。
内蒙古大学生科院讲师杜祎甜为本论文的第一作者,目前主要研究细胞间信息交流如隧道纳米管等在仿生纳米药物递送和相关疾病中的应用。北京大学药学院齐宪荣教授为本论文的通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adhm.202002200










![]() 蒙ICP16002391号-1
蒙ICP16002391号-1