人类衰老的生物学基础仍然是最大的未解科学问题之一。衰老是一个以细胞功能逐渐退化为标志的复杂过程,受生物学因素、环境因素和生活方式等影响。线粒体作为细胞的主要能量枢纽,是高度动态的细胞器,越来越多的证据表明,线粒体功能的改变是衰老过程中潜在的核心调节因子,去除功能失调的线粒体并形成新的健康线粒体可维持其功能和能量稳态,这与长寿密切相关。然而,这些功能在衰老过程中是如何受到影响的,以及替代的抗衰老干预是否需要不同的线粒体网络仍不清楚。PARP1(Poly(ADP-ribose) polymerase-1, PARP1))作为多聚ADP核糖聚合酶,在DNA修复及维持基因组完整性方面发挥重要作用。另一方面,PARP1作为细胞死亡和炎症介质,也参与衰老及长寿的调控。研究发现,抑制PARP1可逆转线粒体损伤并减弱线粒体代谢的遗传缺陷。然而抑制PARP1是否能够延缓衰老过程,PARP1相关信号网络在衰老过程中发挥的具体作用机制尚未可知。
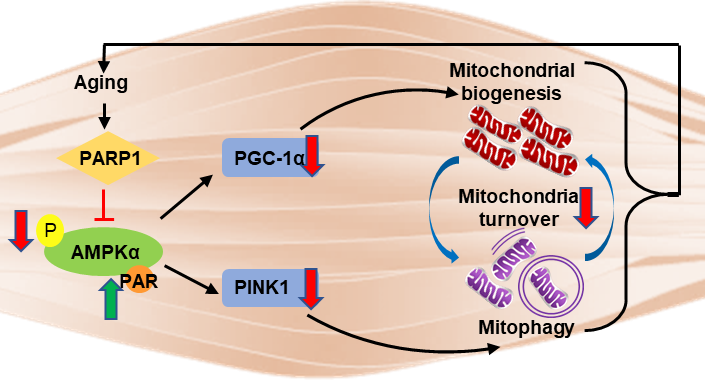
2023年3月23日,刘铁民教授团队在《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)杂志上合作发表了一篇题为Muscle PARP1 inhibition extends lifespan through AMPKα PARylation and activation in Drosophila的论文,该研究指出在年老果蝇中抑制PARP1,可延长寿命,并发现在骨骼肌中敲低PARP1可通过下调AMPK的多糖ADP-核糖基化修饰、增加AMPKα的活性,后者通过上调PGC-1α和PINK1的表达导致线粒体周转加速,肌肉代谢增加、功能增强,阐释PARP1/AMPK参与精准调控衰老进程的分子机制。

作者通过功能缺失(loss of function)策略展开相关研究,发现:骨骼肌特异性敲低Parp1基因(mPARPKD)的果蝇在年老时,爬行能力显著增强,抗饥饿和氧化能力得到明显改善,同时其食物摄入、体重无显著变化;而在年轻果蝇中没有这些表型。在骨骼肌中同时敲低Parp1和Ampkα基因(mDKD)后,其寿命、爬行能力、抗饥饿和氧化能力与对照组相似,显著劣于mPARPKD组。
虽已有研究报道PARP1与AMPKα存在相互作用【6】,但PARP1对AMPKα的精确调控未有定论。本研究通过质谱技术证实了PARP1与AMPKα的相互作用,并发现二者结合域。PARP1功能抑制降低AMPKα的翻译后PARylation修饰、增加AMPKα磷酸化。通过点突变技术,确定了AMPKα的翻译后PARylation修饰位点。
机制研究表明,骨骼肌特异性敲低PARP1上调PGC-1α的表达而使线粒体生成增加,同时上调PINK1表达而促进了线粒体自噬对破损线粒体的清除。本研究首次解释了DNA损伤修复基因Parp1的抑制对能量代谢关键分子AMPKα的精确调控,通过增加线粒体生成和控制线粒体质量,完成骨骼肌中线粒体的高效周转,从而增强骨骼肌代谢功能,实现寿命的延长,提示PARP1抑制除了在癌症肿瘤方面起作用,对延缓衰老也有益处。
刘铁民教授课题组主要研究神经和周边器官比如脂肪、肌肉和肝脏等在调节能量代谢/糖脂代谢中的重要作用。实验室长期招聘优秀博士后,欢迎有神经生物学/生物化学与分子生物学/生理学/细胞生物学/免疫等研究背景,有志从事代谢性疾病机制研究的博士加盟实验室。
原文链接:https://doi.org/10.1073/PNAS.2213857120










![]() 蒙ICP16002391号-1
蒙ICP16002391号-1